미국 식품의약국(FDA)이 2025년 한 해 동안 총 18개의 바이오시밀러를 승인했으며, 국가별로는 한국이 5개로 가장 많은 허가를 받아 2024년에 이어 2년 연속 1위를 기록했다고 한국바이오협회 바이오경제연구센터가 밝혔다.
◆2025년 바이오시밀러 허가 현황
FDA는 1월 26일 2025년 한 해 허가된 바이오시밀러 현황을 공개했다.
바이오시밀러 허가 경로는 FDA가 승인한 바이오의약품(참조 제품)과 매우 유사하고 안전성, 순도 및 효능 측면에서 임상적으로 의미 있는 차이가 없는 생물학적 제품에 대한 축약된 승인 경로다.
FDA는 이 경로가 더 많은 치료 옵션을 제공하고, 환자의 접근성을 높이며, 경쟁을 통해 치료 비용을 잠재적으로 줄이는 데 도움이 된다고 설명했다.
2025년 허가된 18개의 바이오시밀러에는 이전에 승인된 바이오시밀러가 없었던 3개의 참조 제품에 대한 4개의 바이오시밀러가 포함됐다.
또한 18개 중 3개는 상호 교환 가능한 바이오시밀러로 승인돼, 주 법에 따라 처방 의사의 개입 없이 약국에서 참조 제품을 대체할 수 있게 됐다.
◆한국, 2년 연속 최다 허가국 등극
2025년 허가된 18개의 바이오시밀러를 허가 기업의 국적별로 구분하면 한국이 5개로 가장 많이 허가받았다.
이어 인도 4개, 독일과 중국이 각 3개, 미국 2개, 영국과 프랑스가 각 1개를 기록했다.
이로써 한국은 2024년에 이어 2025년에도 바이오시밀러를 가장 많이 허가받은 국가가 됐다.
상호 교환 가능한 바이오시밀러로 승인된 3개 제품은 메릴로그(Merilog·참조제품 노보로그), 오믈리클로(Omlyclo·참조제품 졸레어), 포허디(Poherdy·참조제품 퍼제타)다.
◆FDA 바이오시밀러 누적 허가 현황
▲2015년 이후 총 81개 승인, 2024~2025년 최다 기록
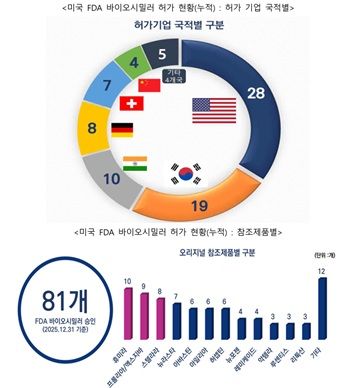
FDA는 2015년부터 2025년까지 20개의 참조 제품에 대해 총 81개의 바이오시밀러를 승인했다.
참조 제품별로는 휴미라에 대한 바이오시밀러가 10개로 가장 많았고, 프롤리아/엑스지바 9개, 스텔라라 8개, 뉴라스타 7개, 아바스틴·아일리아·허셉틴이 각 6개를 기록했다.
뉴포젠과 레미케이드는 각 4개, 악템라·루센티스·리툭산이 각 3개, 엔브렐·란투스·노보로그·솔리리스가 각 2개, 에포젠/프로크릿·퍼제타·타이사브리·졸레어가 각 1개의 바이오시밀러를 보유하고 있다.
연도별로 보면 2015년 최초로 바이오시밀러가 허가된 이래 2024년과 2025년에 각각 18개로 가장 많은 바이오시밀러가 허가됐다.
2015년 1개, 2016년 3개, 2017년 5개, 2018년 7개, 2019년 10개, 2020년 3개, 2021년 4개, 2022년 7개, 2023년 5개를 기록했다.
▲누적 허가 기준 한국 19개로 미국 이어 2위
허가받은 기업의 국적별 누적 현황을 보면, 미국이 28개로 가장 많았고, 한국이 19개로 2위를 차지했다.
이어 인도 10개, 독일 8개, 스위스 7개, 중국 4개, 아이슬란드 2개, 대만·프랑스·영국이 각 1개를 기록했다.
2026년 첫 번째 바이오시밀러는 1월 15일 미국 어코드 바이오파마(Accord BioPharma)의 뉴포젠 바이오시밀러인 필크리(Filkri·필그라스팀-laha)가 허가를 받았다.
◆한국 바이오시밀러 산업의 글로벌 경쟁력
한국은 2015년 FDA 바이오시밀러 허가 제도 도입 이후 지속적으로 허가 실적을 쌓아왔다.
특히 2024년과 2025년 2년 연속 연간 최다 허가국 지위를 유지하며, 누적 허가 수에서도 미국에 이어 2위를 기록했다.
이는 한국 바이오 기업들의 기술력과 글로벌 시장 진출 역량을 보여주는 성과로 평가된다.
[메디컬월드뉴스 김영신 기자]
Copyright ⓒ 메디컬월드뉴스 무단 전재 및 재배포 금지
본 콘텐츠는 뉴스픽 파트너스에서 공유된 콘텐츠입니다.