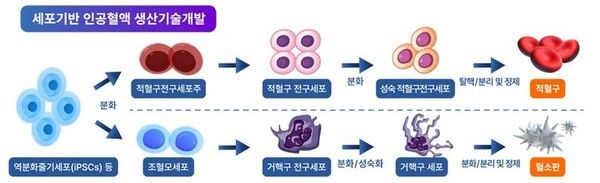
식품의약품안전처가 국가 R&D(연구개발)로 개발 중인 '세포기반 인공혈액'을 첨단바이오의약품으로 분류했다.
뉴시스 보도에 따르면, 식약처는 이러한 분류에 따라 세포기반 인공혈액의 임상시험 진입, 품목허가 신청 등 향후 개발과정의 본격적인 진행이 가능해졌다고 8일 밝혔다.
세포기반 인공혈액은 세계적으로 제품화 사례가 없는 신개념 제품이다. 가이드라인 등 규제체계가 미비하고, 국내 '혈액관리법'은 인체에서 채혈한 혈구 및 혈장만을 혈액으로 규정하고 있어 안전성과 효과성 평가방법 등 제품화를 위한 규제요건이 불명확한 상황이었다.
이에 따라 식약처는 지난해부터 규제정합성 검토 제도를 통해 개발 초기단계부터 제품화에 필요한 규제 요건과 대응 전략 등 컨설팅을 제공해왔다.
제품의 사용 목적, 형태, 작용 기전 등을 종합적으로 검토해 세포기반 인공혈액(적혈구, 혈소판)을 '첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률'에 따른 '첨단바이오의약품'으로 분류를 결정했다.
이번 품목분류로 평가기준 대비 및 임상시험 진입, 허가 신청 등이 가능해졌다. 향후 개발과정이 정상적으로 완료되면 헌혈 혈액을 대체하는 것 외에도 희귀혈액형, 혈소판 감소증 환자 등 특수 수요에도 대응할 수 있을 것으로 기대된다.
식약처 관계자는 "규제기관이 국가 혁신 R&D 초기단계부터 기술과 규제의 정합성을 검토하면서 기존 규제의 틀에 맞지 않는 신개념 제품에 규제의 길을 제시한 사례"라며 "불확실성을 해소하고 개발을 이어갈 수 있도록 지원한 의미가 크다"고 전했다.
이어 "인공혈액 외에도 식의약 혁신제품 개발 국가 R&D에 대한 규제정합성 검토를 확대해 나가고 있다"며 "앞으로도 첨단·혁신 기술의 가치가 제품화를 통해 국민께 신속히 전달될 수 있도록 적극 지원할 계획"이라고 덧붙였다.
한편 세포기반 인공혈액 기술개발사업은 저출생·고령화 및 감염병 발생 등으로 인한 혈액 공급난 대비를 위해 줄기세포로부터 적혈구, 혈소판을 생산하고 상용화하는 기술 확보를 목표로 한다. 지난 2023년도부터 추진했으며 총 사업규모는 약 481억원으로, 복지부·과기부·산업부·식약처·질병청이 참여한다.
Copyright ⓒ 모두서치 무단 전재 및 재배포 금지
본 콘텐츠는 뉴스픽 파트너스에서 공유된 콘텐츠입니다.



