|
◇메드팩토 “백토서팁-임핀지 병용, mOS 2.5배 향상”
메드팩토는 진행성 비소세포폐암(NSCLC) 대상 ‘백토서팁’ 병용요법의 임상 데이터를 미국 면역항암학회(SITC 2024, Society for Immunotherapy of Cancer 2024)에서 공개했다고 11일 밝혔다.
SITC는 면역항암분야에서 가장 큰 규모의 글로벌 학회로 전 세계 63개국, 약 4,600명 이상의 임상의, 과학자, 연구자들을 회원으로 보유하고 있다. 이번 SITC는 11월 6일부터 10일까지 개최됐으며, 메드팩토는 8일(이상 미국 기준)에 ‘백토서팁’과 아스트라제네카 면역항암제 ‘임핀지’(성분명 더발루맙)의 병용 임상 1b/2a상 결과를 발표했다.
메드팩토에 따르면, 이날 데이터 공개와 함께 다수의 해외 제약사 및 연구기관 등에서 ‘백토서팁’의 연구 과정에 큰 관심을 보였다. 특히 일부와는 공동 연구 등에 대해 추가 협의를 진행하기로 했다.
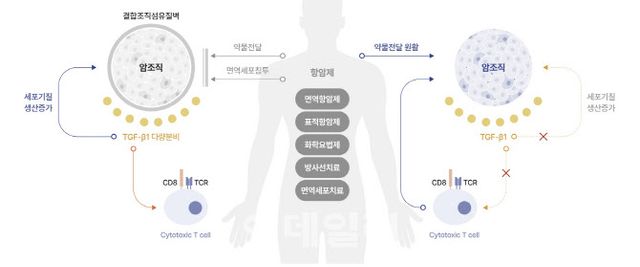
‘백토서팁’은 종양 미세환경 조절과 관련된 TGF-β1 신호전달계를 표적으로 하는 혁신 신약으로, 기존 항암치료제들과 병용투여 시 면역을 활성화하고 전이 및 항암제 내성을 억제해 치료 효과를 극대화하는 새로운 항암치료제다.
이번에 공개된 임상 1b/2a상 결과는 PD-L1 발현율에 따른 치료 효과를 분석한 것으로, 병용요법에 의한 시너지 효과를 확인했다는 점에서 의미가 있다. 특히 PD-L1 발현율이 25% 이상인 환자군에서 객관적 반응률(ORR)은 45.83%, 전체 생존기간 중앙값(mOS)은 41.92개월을 기록했다.
메드팩토 관계자는 “임핀지 단독투여 시 ORR은 20% 내외, mOS는 16.8개월 정도임을 감안하면 백토서팁은 매우 우수한 효과를 보였다”고 강조하면서 “다양한 병용요법에서 백토서팁의 효과가 확인되고 있는 만큼 글로벌 파트너링을 확대해 나갈 예정”이라고 밝혔다.
한편 이번 학회에서는 메드팩토 외 미국 국립암연구소(National Cancer Institute), 호주 피터 맥컬럼(Peter MacCallum) 암센터, 멜버른 대학 등 다양한 기관에서 TGF-β 관련 발표를 진행, TGF-β의 항암치료 가능성에 대한 세계적인 높은 관심을 확인하기도 했다.
◇나이벡, ‘NP-201’ 1b·2a상 승인
나이벡은 호주 ‘인체연구윤리위원회(HREC)’로부터 염증성장질환 치료제 NP-201에 대한 임상 1b/2a상 시험계획(IND)을 승인받았다고 12일 밝혔다.
이번 글로벌 임상 1b/2a상은 피하주사 제형으로 총 78명에게 투약된다. 1b상에서는 24명의 건강한성인을 대상으로 증량 반복투여를 실시해 안전성과 약동학 평가 등을 실시한다. 2a상에서는 경증 및 중증 궤양성 대장염 환자 54명에게 피하주사로 증량 반복 투여를 통해 안전성과 내약성, 약동학 분석 등을 평가한다.
앞서 나이벡은 동일한 약물에 대해 폐섬유증 치료제로 글로벌 임상 1상을 성공적으로 마치며 인체 안전성을 입증한 바 있다.
나이벡 관계자는 “이번 염증성장질환 치료제 글로벌 임상은 약 4개월 정도 소요되며 내년 상반기 중에는 임상결과가 나올 것으로 예상된다”며 “글로벌 임상과 동시에 미국 식품의약국(FDA) 임상 2a 상도 준비 중으로 임상 2상 결과를 최대한 앞당기겠다”고 말했다.
◇셀리드, 오미크론 대응 코로나19 백신 3상 투여 완료
셀리드는 오미크론 대응 백신 ‘AdCLD-CoV19-1 OMI’의 임상 3상 시험 대상자에 대한 모집과 투여를 모두 완료했다고 13일 밝혔다.
이번 임상 3상 시험은 국내를 비롯해 필리핀과 베트남에서 코로나19 예방 백신의 마지막 접종 완료 또는 코로나19에 의한 격리 해제 후 최소 16주 이상 경과한 만 19세 이상 성인 자원자 4000명을 대상으로 진행했다.
셀리드는 계획된 모든 대상자 투여 완료 후 4주차 안전성과 면역원성 데이터를 바탕으로 통계분석을 실시해 중간분석 결과자료를 확보할 계획이며, 중간 분석 결과에 따라 조건부 품목허가를 신청할 방침이다.
또 AdCLD-CoV19-1 OMI의 조건부 품목허가 심사 일정에 맞춰 WHO 및 세계 각국에서 권고하는 신규 변이주 대응 코로나19 백신을 개발해 정부 유관기관과 협의를 통해 긴급사용승인을 획득한 뒤 국가에 공급할 계획이다.
강창율 셀리드 대표는 “임상 1/2상 시험에서 코로나19 백신의 장기적인 면역 유도 효과와 안전성을 확인했기 때문에 임상 3상 시험에서도 긍정적인 결과를 기대한다”고 말했다.
Copyright ⓒ 이데일리 무단 전재 및 재배포 금지
본 콘텐츠는 뉴스픽 파트너스에서 공유된 콘텐츠입니다.